人工智能和脑科学的交叉融合发展为机器智能与人类智能的融合提供了可能,在全球瞩目下,脑机接口技术在医疗场景的应用处在变革前夕,科学家与企业家正力争在这一科技前沿领域通过自主创新取得竞争优势。2023年9月,我国首次提出发展新质生产力这一理念,脑机接口技术作为前沿交叉学科的代表性技术,有望成为先进生产力的突破点之一。
01、什么是脑机接口技术?其在医疗健康领域能发挥何等作用?
脑机接口(brain-computer interface,BCI)指在大脑与外部设备之间建立直接交互的通信和控制通道。现代医学对于脑电信号(Electroencephalogram, EEG)的发现和监测由来已久,随着神经科学的发展,现代医学对运动、视觉、听觉、语言等大脑功能区有了更清晰的了解。如果采集特定大脑功能区的脑电信号并加以解码和分析,则可以翻译大脑的意图及指令,从而应用于精神系统的疾病诊断以及康复治疗。在化学治疗与物理治疗之外,脑机接口技术所代表的数字治疗被视为现代医学最具前景的颠覆式创新领域之一。
脑机接口系统在医疗健康的应用短期以监测和改善为主,中期以替代为主,长期以增强为主。在一些以往较为棘手的神经类疾病中,比如:癫痫、老年痴呆、脑卒中康复、抑郁,甚至于毒品依赖等方向,脑机接口技术有望带来新的突破性的解决方案。
02、脑机接口技术分为哪些核心环节?
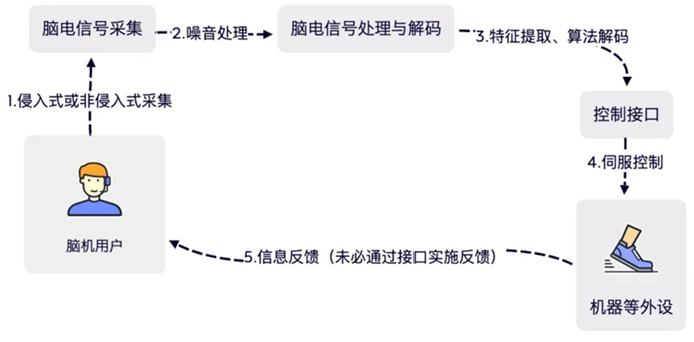
图 BCI系统示意图
在 BCI 系统中信号采集和 算法解析是两个最为核心的步骤,也是 BCI 系统及产品提升有效性的关键突破点。
- 从信号采集端来看,目前市场主流的采集方式为非侵入式采集,非侵入式采集不会将电极植入大脑皮层或对用户造成其他创伤,因此安全性更高,但其取得的信号受到颅骨、皮肤等组织的干扰,会发生较大衰减,且较难精准定位到单个神经元。侵入式采集可获取皮层脑电信号(electrocortico graphy, ECoG)和单神经元记录(Spikes),与颅骨外的头皮脑电信号相比,强度、精度及分辨率都更高,对于医疗级的应用更具价值,但侵入式采集需要通过手术植入电极,且置入式电极不仅会引起排异反应也可能对神经系统造成不可逆的创伤,因此在侵入式采集的领域,如何使用微创方式或柔性电极等先进手段,降低信号采集对于人体造成的创伤是亟待攻破的技术性难题。
- 算法解析是 BCI 框架中的重要组成部分。脑电信号处理的第一步是提高信号质量,通过放大、时/频域滤波、平滑、降维等手段,突出信号特征。处理降噪后的数据将进入第二步解析阶段,即将预处理的脑信号进行特征提取,并通过算法实现对信号的解码,根据脑信号节律的分布与变化情况,得到大脑指令信息。支撑上述高质量信号处理与解析的两大关键技术是算法设计与AI 芯片。
03、脑机接口设备作为医疗器械将按照哪类医疗器械进行监管?
依据影响医疗器械风险程度的因素、以及风险程度高低两类判断标准,医疗器械可以划分为不同的种类(第 I、II、III 类)并接受不同级别医疗器械监管部门采取的不同监督管理措施(如:产品备案或注册批准等)。根据《医疗器械分类目录》的规定,BCI 设备的分类监管要求应参考如下标准:
- 任何侵入式设备基于其对人体的损伤及高风险性,应作为III类医疗器械注册;
- 对于具有增强或刺激类等辅助诊疗及或治疗功效的BCI 设备(无论是否侵入)应作为III类医疗器械监管;
- 其他一般类型的非侵入式BCI 设备应作为II类医疗器械进行监管。
目前,对于非侵入式BCI 设备已经不乏注册成功的产品及企业,对于BCI设备的III类证取证,中外的多家不同技术路线的企业已经进入了临床试验的阶段、开启在人体的数据采集处理和安全有效性验证。此外,随着BCI系统的逐步完善和标准化,后续也可能会存在针对BCI完整设备作为医疗器械整机所对应的某个核心部件的特定类型产品,通常而言,对于该等核心部件由于不会独立被病患所使用,可以考虑采取与其他整机企业合作的方式完成医疗器械注册、无需就核心部件本身单独进行医疗器械产品注册。
04、如何应对产品注册核心环节 ——临床试验?
根据美国食品药品监督管理局(FDA)发布的《用于瘫痪或截肢患者的植入式脑机接口(BCI)设备的非临床和临床考虑因素— FDA 工作人员指南》("BCI 设备指南"),其中对植入式 BCI医疗器械在申请临床研究性器械豁(Investigational Device Exemption,IDE)或注册上市的预提交阶段提出了可借鉴的一般性建议,建议的主要内容包括:
临床前
- 提交对于BCI设备及其软件的完整描述、风险管理评估;
- 考虑人为因素、生物相容性、电磁兼容性等
- 验证系统与组件之间的兼容性符合特定标准并提供科学及数据依据。
动物试验
- 植入式BCI必须提交动物试验以评估体内安全性;
- 动物试验的结果能否作为设备安全性的有利证据;
- 试验方案是否已经尽可能降低动物负担或避免额外试验;
- 试验行为是否符合GLP标准。
临床试验
- 申请者应考虑设备的应用场景并于临床协议中具体描述如何执行;
- 试验面对的患者群体范围应根据潜在益处大于风险的原则结合患者需求及风险承受能力考虑;
To read the full article click here
The content of this article is intended to provide a general guide to the subject matter. Specialist advice should be sought about your specific circumstances.

